Cell揭示三阴性乳腺癌新靶点——Cop1
以PD-1抗体为代表的免疫检查点抑制剂疗法虽然在肺癌、结直肠癌、皮肤癌等中具有显著的临床益处,但是只有少部分三阴性乳腺癌患者能从中获益。三阴性乳腺癌的免疫抑制性肿瘤微环境降低了肿瘤对这类药物的有效应答,因此如果能找到新靶点来重编程肿瘤微环境将有助于提高三阴性乳腺癌中免疫治疗的疗效。
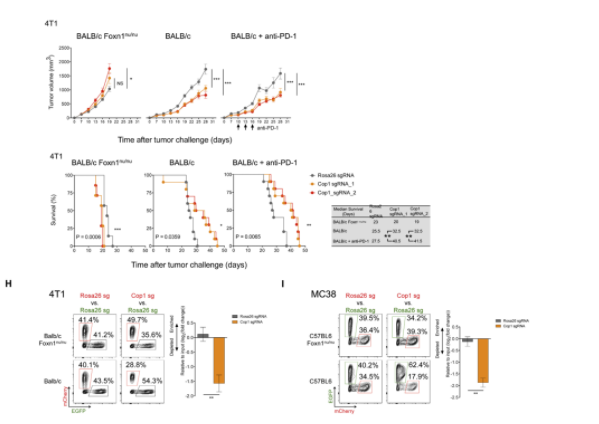
9月27日,在Cell发表的一项最新研究中,来自Dana-Farber癌症研究所的研究人员发现癌细胞中E3泛素连接酶Cop1的缺失会减少巨噬细胞相关趋化因子的分泌和肿瘤巨噬细胞浸润,并能增强肿瘤对免疫检查点抑制剂治疗的应答,因此Cop1是提高三阴性乳腺癌免疫治疗效果的潜在靶点。
为了确定导致癌细胞肿瘤免疫力低下的靶点,研究人员利用CRISPR基因敲除在三阴性乳腺癌和结肠癌小鼠模型中进行了筛选,并将E3泛素连接酶Cop1鉴定为肿瘤浸润性M2巨噬细胞和抗PD-1应答的重要调节因子。
在小鼠模型中进行的实验表明,与裸鼠相比,在有无PD-1抗体治疗的情况下,敲除Cop1的三阴性乳腺癌小鼠模型的肿瘤进展都显著减缓,而且携带Cop1缺失肿瘤的野生型小鼠在有无PD-1抗体治疗的情况下,生存期都得到了延长。在结肠癌小鼠模型中,Cop1的敲除也导致了肿瘤生长的减少和生存期的延长。
进一步的分析表明,Cop1通过影响C/ebpδ的蛋白酶体降解来影响癌症进展。Cop1的底物,接头蛋白Trib2通过连接Cop1和C/ebpδ,使C/ebpδ多聚泛素化,C/ebpδ能抑制癌细胞释放巨噬细胞趋化因子。
三阴性乳腺癌细胞中Cop1的缺失使得C/ebpδ的稳定性和染色质的结合增加,从而抑制了参与巨噬细胞趋化和活化的细胞因子的表达,这使得肿瘤巨噬细胞浸润减少,增强了肿瘤对免疫检查点抑制剂的应答。
作者表示,目前虽尚无有效的Cop1抑制剂,但MDM2、cIAP、TRIM24等其它E3泛素连接酶已开发出来了小分子或PROTAC药物,未来也将开发出有有效的Cop1靶向抑制剂。
参考资料:
Wang X.Q., Tokheim C., Stan Gu S.Q. et al. In vivo CRISPR screens identify the E3 ligase Cop1 as a modulator of macrophage infiltration and cancer immunotherapy target. Cell (2021)
本站部分信息来自网络整理,如有侵权,请您联系我们,我们会在第一时间将其删除!
最新发布
Recommend article-

新疆也有戊型肝炎疫苗啦!疫苗届的国货之光,你值得接种!
发布2022-10-27/阅读1608 -

新疆也有戊型肝炎疫苗啦!疫苗届的国货之光,你值得接种!
发布2022-10-27/阅读822 -

天天吃二甲双胍,为何血糖不降反升?
发布2022-10-19/阅读1477 -
壮骐洋葱钙固体饮料,补钙壮骨,全新上线
发布2022-10-18/阅读916 -

睡眠不足对身体有哪些危害 睡眠不足头疼有什么好办法吗?
发布2022-10-10/阅读1896 -

疫情刷新抑郁症发病率?6个症状应警惕
发布2022-10-10/阅读1117 -

诺奖得主“巧妙化学”或助癌症治疗取得突破
发布2022-10-10/阅读893 -

糖友假期出游,牢记2个吃“胍”建议
发布2022-10-10/阅读951 -

暖心!看完《刘指导不为人知的一面》,网友纷纷种草伊利欣活
发布2022-09-30/阅读1377 -

手心脚心发热是怎么回事 手心脚心发热怎么调理好
发布2022-09-29/阅读1570
热门文章
HOT NEWS


